外泌体,这些微小的纳米级囊泡,宛如生命微观世界中的 “神奇信使”,持续释放着令人惊叹的能量。在过去的推文里,我们已初步领略了外泌体的魅力,而如今,最新的研究成果更是将其推向了医学应用的新高峰。接下来,让我们一同深入探索外泌体在当下的前沿应用。
图1.图片来源于网络
一、神经系统疾病治疗的新曙光
脊髓损伤、视神经损伤等神经系统疾病,常给患者带来难以逆转的痛苦,恢复之路充满荆棘。但近期,NurExone Biologics 公司带来了令人振奋的消息。他们研发的外泌体药物 ExoPTEN,如同一位精准的 “微观医生”,针对脊髓损伤、视神经损伤及面神经损伤,展现出卓越的疗效,已成功获得 FDA 和 EMA 的孤儿药认证,并计划于 2026 年开启临床试验。
ExoPTEN 的神奇之处在于,它借助间充质干细胞来源的外泌体,巧妙地将 PTEN siRNA 递送至受伤神经元,精准下调 PTEN 基因。PTEN的抑制促进轴突再生和神经修复。不仅如此,外泌体能抑制局部炎症,引导免疫细胞向修复模式转变,为神经再生营造出理想的微环境。在完全横断大鼠模型中,经鼻给药后,大部分恢复了运动功能、感觉和膀胱控制能力,部分单次高剂量治疗的大鼠甚至实现了可测量的步态恢复,效果着实令人惊叹。
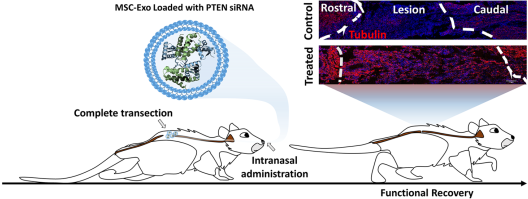
图2.鼻内ExoPTEN治疗显著促进脊髓损伤大鼠的功能恢复
二、肺部疾病治疗的创新突破
肺纤维化,作为一种严重的慢性肺部疾病,5年生存率不足40%,传统治疗手段往往难以取得理想效果。然而,清华团队的最新研究成果为患者带来了新的生机。他们建立了严谨规范的外泌体制备与质量控制体系,深入表征了人脐带间充质干细胞来源外泌体的miRNA、蛋白质和代谢物特征。
动物实验中,雾化吸入干细胞外泌体展现出强大的靶向富集能力,能够精准抵达肺组织,显著改善博来霉素诱导的小鼠肺纤维化进程。治疗组小鼠的生存率从 20% 大幅提升至 80%,肺体积逐步恢复,肺损伤程度明显减轻,血氧饱和度及肺功能指标也得到显著改善。在临床 I期试验中,24名肺纤维化患者参与了随机、单盲、安慰剂对照研究。结果显示,雾化吸入人脐带间充质干细胞来源外泌体不仅安全性良好,未出现严重不良事件,而且在肺功能(用力肺活量 FVC、最大自主通气量 MVV)和呼吸健康状态(通过SGRQ评分和LCQ评分)方面,相比仅接受常规治疗的对照组,接受联合治疗的患者均有显著改善。其中,两例炎症后肺纤维化患者治疗后的影像学检查显示病灶显著改善,这一成果为肺纤维化治疗开辟了全新的路径,让我们看到了逆转肺纤维化的希望。
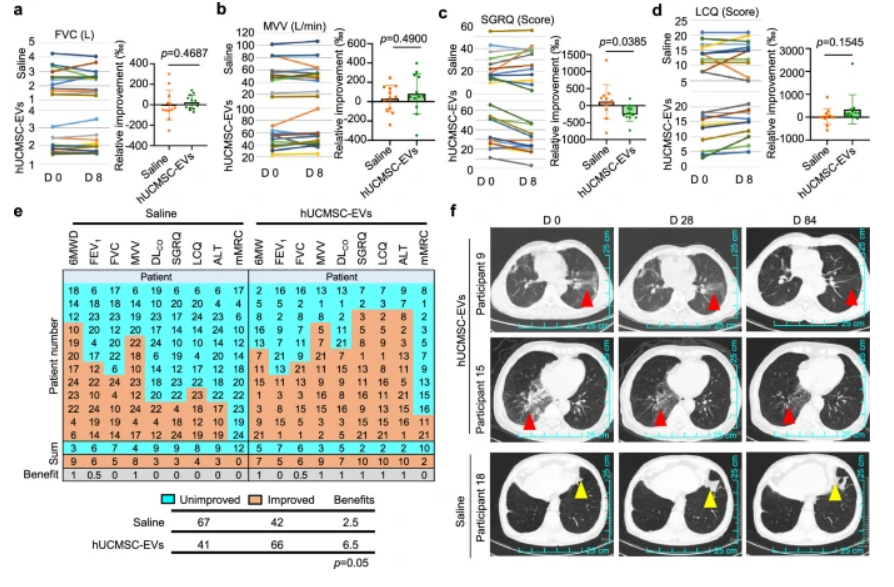
图3. 雾化吸入hUCMSC EVs治疗肺纤维化的临床疗效
与此同时,名为“一项评价雾化吸入脐带间充质干细胞外泌体(MSC-Exo)治疗中至重度哮喘的安全性和耐受性的单中心、随机、单臂Ⅰ期临床研究” 项目也在烟台毓璜顶医院正式启动。哮喘作为常见的慢性呼吸道疾病,全球有数亿患者深受困扰,传统治疗方法难以逆转气道重塑。而外泌体雾化吸入疗法有望打破这一困境,通过调节巨噬细胞极化,抑制促炎 M1 型巨噬细胞,促进抗炎 M2 型巨噬细胞,从根源上减轻气道炎症,促进气道上皮细胞修复,减少气道重塑,改善肺功能,降低患者对长期激素治疗的依赖,为哮喘患者带来新的治疗选择。
三、视网膜疾病治疗的新希望
视网膜缺血再灌注损伤,作为多种视网膜病变的共同病理基础,长期以来缺乏有效的治疗手段。不过,陶勇教授团队联合中科院过程工程所带来了创新疗法 ——工程化神经干细胞外泌体(CataKNexo)。该疗法基于对大规模眼内液样本的深入分析,精准靶向视网膜缺血再灌注损伤。
CataKNexo是具有聚赖氨酸(K10)修饰和过氧化氢酶表达的神经干细胞外泌体,能够精准富集于视网膜节细胞层,并借助聚赖氨酸的穿透性抵达外核层。在多种体内/外模型实验中,CataKNexo 展现出强大的治疗效果。在体外模拟的视网膜三层结构 Transwell 模型中,它能通过 K10 介导的转胞吞作用顺利到达外核层;在 RIRI 小鼠模型中,有效抑制了视网膜因过氧化氢引起的细胞死亡,发挥了神经保护作用,使小鼠的视网膜功能得到部分恢复;在 RIRI 小型猪模型中,同样展现出令人惊喜的抗氧化和视神经保护作用,为视网膜疾病患者带来了重见光明的新希望。
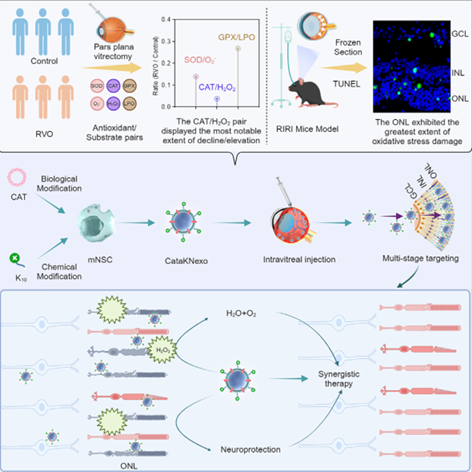
图4. CataKNexo 设计、制备及作用机制
不仅如此,中山大学中山眼科中心卓业鸿/苏文如教授团队发现,间充质干细胞来源的外泌体富含miR-21a-5p其能够保护视网膜神经细胞且有抗炎作用,并且首次证实 TNF-α预处理干细胞可增强其外泌体的神经保护作用,为视网膜神经损伤治疗提供了新的治疗方向。
四、股骨头缺血性坏死治疗的新途径
股骨头缺血性坏死(ONFH),常导致患者疼痛难忍,严重时甚至关节塌陷。研究人员发现,M2巨噬细胞衍生的外泌体(M2-Exos)为ONFH 治疗带来了新的曙光。M2-Exos中的miR-93-5p能够减少中性粒细胞NETs形成,同时提高内皮细胞血管生成能力。
研究团队通过单细胞RNA测序、构建动物模型等实验手段,充分验证了M2-Exos的治疗有效性。富含miR-93-5p的M2-Exos不仅有效解决ONFH的问题,还具备非侵入性、精准定位受损骨组织以及双重作用机制(同时解决免疫功能障碍和血管损伤)等诸多优势,为 ONFH 患者提供了新的治疗选择,并且有望在其他缺血性骨病治疗中发挥重要作用。
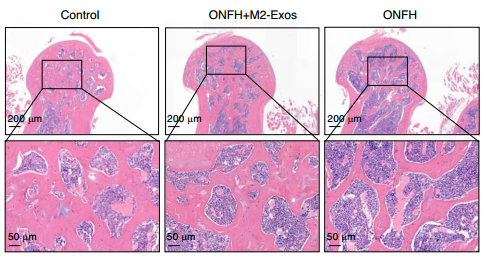
图5. M2-Exos 减少体内NETs形成
外泌体在医学领域的最新应用成果令人瞩目,从神经系统到肺部,从视网膜到骨骼,它正逐步改写多种疾病的治疗格局。当然,目前外泌体治疗仍处于研究和发展阶段,在规模化生产、作用机制深入研究、长期安全性观察等方面还面临诸多挑战。但我们有理由相信,随着科研人员的不懈探索,外泌体必将在未来为人类健康带来更多的惊喜,成为攻克疑难病症的有力武器。让我们共同期待外泌体在医学舞台上绽放更加耀眼的光芒!
1. Shaowei Guo, Nisim Perets, Oshra Betzer, Shahar Ben-Shaul, et al. Intranasal Delivery of Mesenchymal Stem Cell Derived Exosomes Loaded with Phosphatase and Tensin Homolog siRNA Repairs Complete Spinal Cord Injury. ACS Nano. 2019, 13, 10015-10028. doi: 10.1002/sctm.19-0432.
2. Meng Li. et al. Clinical investigation on nebulized human umbilical cord MSC-derived extracellular vesicles for pulmonary fibrosis treatment. Signal Transduction and Targeted Therapy. (2025) 10:179. doi.org/10.1038/s41392-025-02262-3.
3. Weiqiang Yang, et al. Catalytic neural stem cell exosomes for multi-stage targeting and synergistical therapy of retinal ischemia-reperfusion injury. Cell Reports Medicine 6,102052. doi.org/10.1016/j.xcrm.2025.102052.
4. Guanzhi Liu,et al. M2 macrophages-derived exosomes for osteonecrosis of femoral head treatment: modulating neutrophil extracellular traps formation and endothelial phenotype transition. Bone Research (2025) 13:42. doi.org/10.1038/s41413-025-00412-5.